開発方針

当社グループは、「病気と苦痛に対する人間の闘いのために」という企業理念のもと、これまで克服されていない病気や、いまだ患者さんの治療満足度が低く、医療ニーズの高い疾患領域に挑戦し、独創的かつ画期的な医薬品の創製に向けて努力を積み重ねています。
現在、開発パイプラインには、オプジーボに加えて、抗体医薬品を含む抗がん剤の新薬候補化合物をはじめ、自己免疫疾患や神経系疾患の治療薬候補などがあり、開発を進めています。なかでも、がん治療の領域は医療ニーズが高いことから、重要な戦略分野と位置づけています。
PoCの早期確立
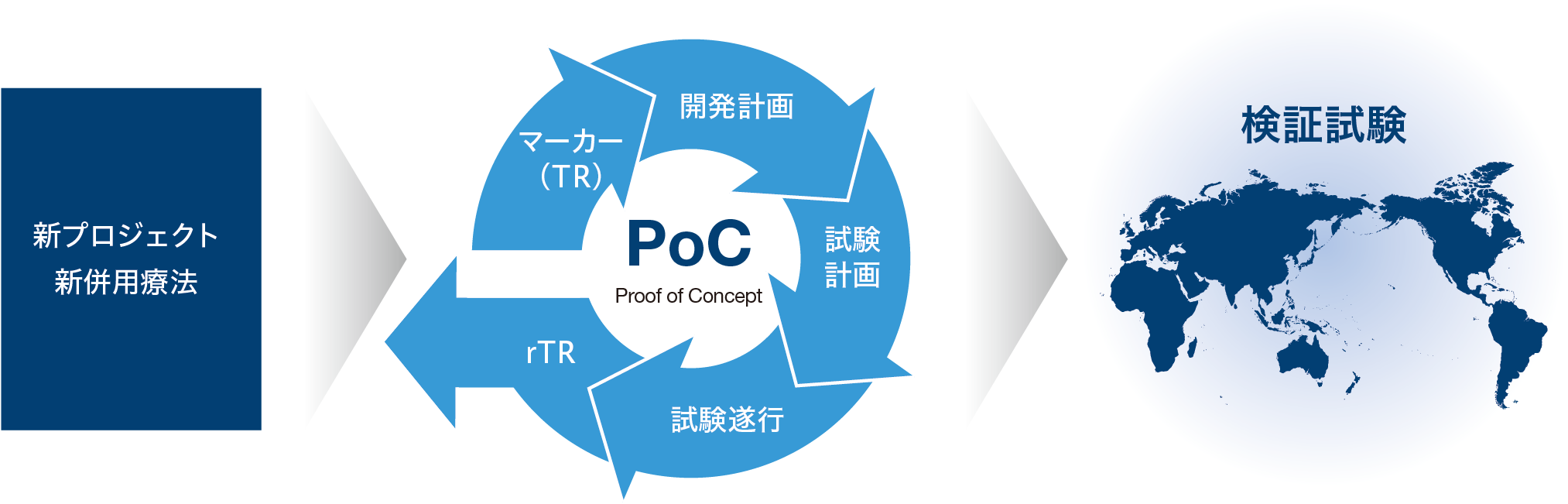
自社の創薬研究により生み出された化合物やライセンス活動により獲得した化合物を、病気で苦しんでいる世界中の患者さんに一日も早くお届けするため、スピーディーな臨床開発と成功確率の向上に取り組んでいます。化合物の製品価値をいち早く明らかにするために、日本、米国、欧州の臨床開発基盤を柔軟に用いて、PoCの早期確立に取り組んでいます。そのために、疾患選択を含めた適切な開発計画、的確に有効性を捉えるための試験計画を立案し、試験を計画通りに推進していきます。また、TR※1による臨床マーカーの探索機能を強化し、臨床試験で得られた結果を研究にフィードバックして新たな創薬プロジェクトの立ち上げに結び付けるrTR※2にも取り組み研究開発のサイクルを回していきます。
- TR:Translational Research の略。基礎研究で得られた知見を臨床における診断、治療および効果判定などに応用する手法。
- rTR: Reverse Translational Research の略。臨床で得られた知見を基礎研究にフィードバックする手法。
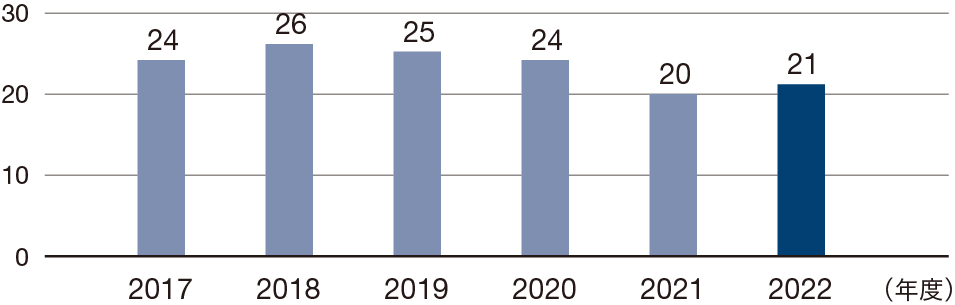
臨床開発段階の品目数
製品価値を高めるために既存製品の効能追加を目指した臨床開発も進めています。オプジーボについては、適応がん腫の拡大、より早い治療段階からの使用、治療効果を高めるための併用療法の確立を目指した臨床試験を実施しています。また、パイプラインを強化するために新規化合物のグローバル開発を積極的に進めています。2022年度に臨床段階にある品目数は21 品目でした。
今後も、新たな治療薬を待ち望む患者さんのために、国内のみならず全世界で積極的に臨床開発を進めていきます。
グローバル臨床開発体制
欧米への拠点設置による開発体制構築
欧米では、ONO PHARMA USA, INC.(OPUS)とONO PHARMA UK LTD.(OPUK)において、早期臨床試験の実施に加え、後期臨床試験から承認申請までを自社で実施できる開発体制の構築を進めます。

